CATATAN
Puji dan Syukur saya panjatkan ke Hadirat Allah SWT, karena berkat Rahmat dan Karunia-Nya sehingga saya dapat membuat dan menyusun Blog ini dengan baik dan tepat pada waktunya. Dalam Blog ini saya membahas mengenai Materi-materi yang dipelajari ketika mengikuti mata kuliah Termodinamika.
Blog ini dibuat dengan berbagai pengumpulan data dan informasi dari berbagai buku dan link juga untuk menyelesaikan tantangan dan hambatan selama mengerjakan dan pembuatan Blog ini, dimana Blog ini sendiri dibangun untuk memenuhi salah satu proyek mata kuliah Termodinamika dengan dosen pengampu Bapak Apit Fathurohman, S. Pd., M. Si. Tak dapat dipungkiri bimbingan dari dosen pengampu saya sangatlah penting dan mengambil andil tersendiri dalam pembuatan Blog ini, Oleh karena itu, saya mengucapkan terima kasih yang sebesar-besarnya.
Saya menyadari bahwa masih banyak kekurangan yang mendasar pada isi maupun tampilan Blog ini. Oleh karena itu saya mengundang pembaca untuk memberikan saran serta kritik yang dapat membangun bagi Blog ini. Kritik konstruktif dari pembaca sangat kami harapkan untuk penyempurnaan Blog ini.
Akhir kata semoga Blog ini dapat memberikan manfaat bagi kita sekalian.
Palembang, Januari 2015
Pembuat Blog
Desty Permata Sari
(06111381320004)
Sabtu, 25 April 2015
Kamis, 23 April 2015
Aplikasi Termodinamika : Air Conditioner
Ø Prinsip Kerja ( AC )
Berita Termo : EKG, MURAH DAN EFISIEN
HUKUM BOYLE
- A. Teori Kinetik Gas Ideal
- Terdiri atas partikel dalam jumlah yang banyak dan tidak ada gaya tarik-menarik antarpatikel
- Setiap partikel gas selalu bergerak dengan arah acak(sembarang)
- Ukuran partikel diabaikan terhadap ukuran wadah
- Setiap tumbukan yang terjadi secara lenting sempurna.
- Partikel-partikel gas terdistribusi merata pada seluruh ruang dalam wadah.
- Gerak partikel gas memenuhi hukum newton tentang gerak.
Rabu, 22 April 2015
Contoh soal Termodinamika
APLIKASI HUKUM PERTAMA PADA REAKSI KIMIA (TERMOKIMIA)
Termokimia mempelajari efek panas yang terjadi baik dalam perubahan secara kimia (reaksi kimia) maupun secera fisika (proses penguapan, peleburan, dsb.). Efek panas dapat bersifat eksoterm, yaitu bila terjadi pelepasan kalor, dan endoterm, yaituu bila proses disertai dengan penyerapan kalor. Jum!ah kalor yang bersangkutan dalam suatu reaksi bergantung pada jenis dan jumlah zat-zat yang béreaksi, pada keadaan fisik zat-zat pereaksi dan hasil reaksi, pada temperatur dan pada tekanan (terutama pada reaksi gas). Oleh karena itu kalor reaksi dan suatu reaksi hendaknya dinyatakan bersama-sama dengan persamaan reaksinya, dimana kondisi-kondisi reaksi tertera dengan jelas.
1. Kalor reaksi pada Volume Tetap dan pada Tekanan Tetap
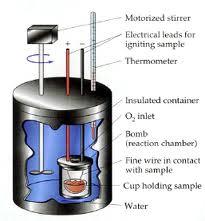
Dalam termokimia ada dua kondisi khusus yang penting, yaitu volume tetap dan tekanan tetap, oleh karena pada kedua kondisi ini kalor reaksi dapat dikaitkan dengan fungsi-fungsi termodinamika tertentu. Bila reaksi dikerjakan pada volume tetap (misalnya dalam kalorimeter bom), maka kalor reaksinya sama dengan perubahan energi dalam sistem, qp = ∆U, sedangkan pada tekanan tetap, kalor reaksi sama dengan perubahan entalpi, qv = ∆H. Hubungan antara kedua besaran ini dapat diturunkan sebagai berikut,
H= U+pV
dH =dU + d(pV) atau
∆H = ∆U + ∆(pV) …………………………………………………………………….. (22)
Bila semua zat-zat pereaksi dan hasil reaksi sebagai cairan atau padatan, maka harga ∆(pV) sangat kecil (kecuali bila tekanan sangat tinggi) dibandingkan terhadap ∆H atau ∆U sehingga dapat diabaikan, dalam hal ini ∆H ≈ ∆U. Dalam reaksi yang menyangkut gas, harga ∆(pV) bergantung pada perubahan jumlah mol gas yang terjadi dalam reaksi. Dengan pengandaian gas bersifat ideal, ∆(pV) = ∆n(RT), sehingga persamaan (22) menjadi;
∆H = ∆U + ∆n(RT) (T tetap) ……………………………………………………...(23)
dimana ∆n = jumlah mol gas hash reaksi — jumlah mol gas pereaksi. Persamaan ini berlaku apabila sistem hanya dapat melakukan kerja volume.
2. Penentuan Kalor Reaksi Secara Eksperimen (Kalorimetri)
Hanya reaksi-reaksi berkesudahan yang berlangsung dengan cepat dapat ditentukan kalor reaksinya secara eksperimen, seperti reaksi pembakaran, reaksi penetralan dan reaksi pelarutan. Penentuan ini biasanya menyangkut pengukuran perubahan suhu dari larutan atau dari air dalam kalorimeter.
3. Perhitungan Kalor Reaksi
Reaksi kimia kebanyakan dikerjakan pada tekanan tetap, sehingga pada perhitungan ini hanya diperhatikan entalpi reaksi, ∆H.
Perhitungan kalor reaksi ini dapat dilaksanakan dengan cara;
1) Perhitungan dengan menggunakan Hukum Hess.
2) Perhitungan dan data Entalpi Pembentukan Standar.
3) Perkiraan Entalpi Reaksi dan data Energi Ikatan.
4. Kebergantungan Entalpi Reaksi pada temperatur.
Pada umumnya entapi reaksi merupakan fungsi dari temperatur dan tekanan. Karena pengaruh tekanan cukup rumit, maka disini hanya akan diturunkan pengaruh temperatur pada ∆H.
Perhatikan reaksi,
v1 A1 + v2 A2 → v3 A3 + v4 A4
Perubahan entalpi reaksi diberikan oleh,
∆H = Hhasil reaksi — Hpereaksi
∆H = ∑ vi Hi …………………………………………………………………………...(24)
Perubahan ∆H dengan temperatur diperoleh dengan cara mendeferensialkan persamaan (24) terhadap temperatur pada tekanan tetap,
[∂(∆H)/∂T ]p = ∆Cp…………………………………………………………………….(25)
Persamaan ini dikenal sebagai persamaan Kirchhoff. Persamaan (25) dapat diintegrasi apabila Cp, sebagai fungsi temperatur diketahui. Kalau Cp, dapat dianggap tetap antara T1 dan T2, misalnya kalau perbedaan antara kedua temperatur ini tidak besar, maka integrasi dan persamaan (25) menghasilkan,
∆H2 - ∆H1 = ∆H (T2 – T1) …………………………………………………………. (26)
Kalau Cp tidak dianggap tetap, maka
∆H2 - ∆H1 = ∆Cp dT ……………………………………………………………(27)
untuk dapat memudahkan perhitungan ∆H pada pelbagai temperatur, pada tekanan tetap, sebaiknya terlebih dahulu ditentukan ∆H = f(T). Hal ini dapat dilakukan dengan,
∆HT = ∫∆Cp dT + I ……………………………………………………………………..(28)
dengan I ialah tetapan integrasi.
pengertian termodinamika
Pengertian Termodinamika. Termodinamika adalah bidang ilmu yang meliputi hubungan antara panas dan jenis energi lainnya. Termodinamika ditemukan dan diteliti awal tahun 1800-an. Pada saat itu, itu terkait dengan
ENTROPI DAN HUKUM KEDUA TERMODINAMIKA
PENGERTIAN SIKLUS RANKINE
Aplikasi Termodinamika : KULKAS
Aplikasi Termodinamika : PENGUKUR SINAR MATAHARI JENIS CAMPBLE STOKES
Aplikasi Termodinamika : Termometer Bimetal Mekanik
Cara Kerja
Aplikasi Termodinamika dalam berbagai alat - alat rumah tangga
Tokoh Fisika, Termodinamika : Jacobus Henricus van 't Hoff
Aplikasi Termodinamika : BAROGRAPH
Komunitas Blogger UNSRI
para blogger kini berkomunitas...
kami hadir dan siap bantu anda...
kami adala komblog(komunitas blogger) dari unsri!
#nadaiklanekstrakkulitbuah
Azaz Black
Tokoh Fisika Termodinamika : Rudolf Julius Emanuel Clausius
Radiasi Benda Hitam
Sistem Hidrostatis
Sistem hidrostatis merupakan zat kimia yang tidak diperhatikan sifat kelistrikannya, kemagnetannya, elastisitasnya, dan sifat tegangan permukaannnya
Karakteristik (Sifat) Sistem
KONSEP DASAR TERMODINAMIKA
Minggu, 15 Maret 2015
Konsep Suhu dan Kalor
Usaha dan Proses dalam Termodinamika
Pengertian Kesetimbangan Termodinamika
 Proses
Proses
Siklus Termodinamika
Sistem dan Lingkungan Termodinamika
Hukum Kedua Termodinamika
Termodinamika dalam kehidupan sehari-hari
Termodinamika sudah sangat tidak asing didalam kehidupan sehari-hari, banyak sekali peristiwa termodinamika yang terjadi dalam kehidupan. Sebagai contohnya perubahan suhu yang terdapat pada badan kita, kemudian beberapa peralatan rumah tangga yang menggunakan konsep termodinamika dan beberapa peralatan lainnya.
Definisi dan Pengertian kalorimeter:
Hukum Ke Nol Termodinamika
1. Hukum ke 0 termodinamika
Hukum ke 0 termodinamika berbunyi : ” Jika 2 buah benda berada dalam kondisi kesetimbangan termal dengan benda yang ke 3, maka ketiga benda tersebut berada dalam kesetimbangan termal satu dengan lainnya” . Untuk lebih memahami tentang isi hukum ke 0 termodinamika, maka bunyi hukum ini dapat ditulis ulang dengan kata-kata yang lebih sederhana yaitu Jika benda A mempunyai temperatur yang sama dengan benda B dan benda B mempunyai temperatur yang sama dengan benda C maka temperatur benda A akan sama dengan temperatur benda C atau disebut ketiga benda (benda A, B dan C) berada dalam kondisi kesetimbangan termal. Kondisi ini dapat digambarkan sebagai berikut:
Hukum Pertama Termodinamika
- Hukum I Termodinamika menyatakan bahwa :
Senin, 09 Maret 2015
KONSEP DASAR TERMODINAMIKA
Ilmu Termodinamika Menyanggah Evolusi - Keruntuhan Teori Evolusi
Contoh Soal dan Pembahasan Bagian 1
Suatu gas memiliki volume awal 2,0 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 4,5 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut!
(1 atm = 1,01 x 105 Pa)
Pembahasan
Data :
V2 = 4,5 m3
V1 = 2,0 m3
P = 2 atm = 2,02 x 105 Pa
Isobaris → Tekanan Tetap
W = P (ΔV)
W = P(V2 − V1)
W = 2,02 x 105 (4,5 − 2,0) = 5,05 x 105 joule
Soal No. 2
1,5 m3 gas helium yang bersuhu
Rumus Termodinamika Bagian 1
Hukum Termodinamika I
ΔU = Q − W
Keterangan :
ΔU = perubahan energi dalam (joule)
Q = kalor (joule)
W = usaha (joule)
Proses-proses
Isobaris → tekanan tetap
Isotermis → suhu tetap
Tokoh-tokoh dalam Sejarah Termodinamika
Sejarah Penemuan Termodinamika
Istilah termodinamika sering kali kita dengar didalam kehidupan kita. Setiap perbendaharaan kata yang sering kita gunakan itu tentunya memiliki arti dan makna tersendiri. Begitupun kata termodinamika, seperti yang dikatakan oleh Widoyo. (2011:1), “Termodinamika (bahasa Yunani: thermos= ‘panas’ and dynamic= ‘perubahan’) adalah fisika energi, panas, kerja, entropi dan kespontanan proses”. Hubungan-hubungan yang ada dalam termodinamika itu berasal dari mekanika statistik, oleh sebab itu banyak sekali keterkaitan antara termodinamika dan mekanika statistik, bahkan terdapat beberapa kajian yang sama seperti pandangan terhadap suatu sistem. Pada sebuah sistem dimana terjadi suatu proses perubahan wujud atau pertukaran energi, ternyata termodinamika klasik tidak berhubungan dengan kecepatan suatu proses reaksi berlangsung atau biasa kita sebut kinetika reaksi.